Азотная кислота (HNO3)
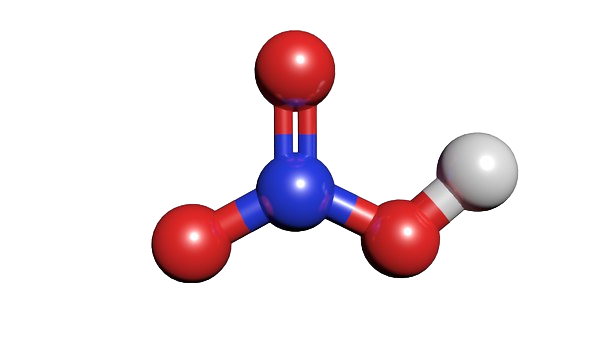
Азотная кислота (HNO3) является одной из наиболее распространенных неорганических кислот и имеет важное значение в множестве областей. Эта химическая соединение с составом HNO3, образуется путем соединения азота и кислорода. Азотная кислота привлекает внимание исследователей и промышленности благодаря ее многочисленным свойствам и возможностям применения. В данной статье мы рассмотрим значение и применение азотной кислоты в различных сферах, а также ее влияние на окружающую среду.10:56
Азотная кислота (HNO3) - это бесцветная или желтоватая жидкость с характерным раздражающим запахом. Она относится к классу неорганических кислот и является одной из наиболее распространенных и важных кислот в химическом промышленном производстве. Азотная кислота образуется путем окисления аммиака (NH3) с помощью каталитического окислителя, такого как платина или родий.
Свойства азотной кислоты
Физические свойства азотной кислоты (HNO3):
- Молярная масса: 63.01 г/моль
- Плотность: около 1.51 г/см³ (концентрированная форма)
- Температура плавления: -42 градуса Цельсия
- Температура кипения: 83 градуса Цельсия
- Растворимость: полностью смешивается с водой во всех пропорциях (это сильная кислота)
Химические свойства азотной кислоты (HNO3):
- Азотная кислота (HNO3) является сильным оксидирующим агентом, способным окислять многие органические и неорганические вещества.
- Она образует соли, известные как нитраты, при реакции с основаниями или металлами.
- Азотная кислота (HNO3) обладает кислотными свойствами и реагирует с основаниями, образуя соли и воду.
- В азотной кислоте имеется алкилированная группа NO2, которая обусловливает ее высокую реактивность.
Реактивность азотной кислоты (HNO3):
- Азотная кислота (HNO3) является строго запрещенным взрывчатым веществом и должна быть обрабатываться с особой осторожностью.
- При нагревании азотная кислота может дезинтегрироваться с образованием оксидов азота и высвобождением большого объема газов, что может привести к взрыву.
- Она может вызывать ожоги на коже и повреждения глаз, поэтому необходимо соблюдать меры предосторожности при работе с ней.
Процесс получения азотной кислоты (HNO3)
Азотная кислота (HNO3) является одним из важных химических соединений, используемых в различных отраслях промышленности. Существует несколько методов получения азотной кислоты, но наиболее распространенными являются процессы окисления аммиака или оксида азота.
Один из основных методов получения азотной кислоты - это процесс окисления аммиака. Он осуществляется в несколько стадий, таких как:
- Синтез аммиака: начальным этапом процесса является синтез аммиака (NH3) из азота (N2) и водорода (H2) посредством использования катализатора (обычно железа). Реакция может быть представлена следующим образом:
N2 + 3H2 -> 2NH3 - Окисление аммиака: вторым этапом является окисление аммиака до оксида азота (NO). Реакция происходит с использованием катализаторов, таких как платина или родий, при высоких температурах:
4NH3 + 5O2 -> 4NO + 6H2O - Окисление оксида азота: окислительный катализатор применяется для окисления оксида азота (NO) до диоксида азота (NO2):
2NO + O2 -> 2NO2 - Абсорбция в воде: оксид азота (NO2) реагирует с водой (H2O), образуя азотную кислоту (HNO3):
3NO2 + H2O -> 2HNO3 + NO
Однако существуют и другие методы получения азотной кислоты. Например, процесс окисления азота (N2) кислородом (O2) при высоких температурах и давлениях может также использоваться для производства азотной кислоты.
В завершение, процесс получения азотной кислоты является сложным и требует использования специального оборудования и катализаторов. Он широко применяется в промышленности для производства разнообразных продуктов, таких как удобрения, взрывчатые вещества и другие химические соединения.
Реакции азотной кислоты с различными веществами
Реакции азотной кислоты (HNO3) с различными веществами могут проявляться в различных формах. Вот основные реакции азотной кислоты с различными классами веществ:
Реакции с металлами:
- Азотная кислота окисляет металлы, такие как железо (Fe) или цинк (Zn), образуя соответствующие нитраты (Fe(NO3)3 или Zn(NO3)2) и выделяя оксиды азота (NO или NO2) и воду.
- Некоторые металлы, такие как медь (Cu) и серебро (Ag), не реагируют с азотной кислотой из-за своей защитной пленки оксида, которая препятствует дальнейшей реакции.
-
Реакции с основаниями:
- Азотная кислота (HNO3) реагирует с основаниями, например, гидроксидом натрия (NaOH) или гидроксидом аммония (NH4OH), образуя нитрат соответствующего металла (NaNO3 или NH4NO3) и воду.
-
Реакции с органическими соединениями:
- Азотная кислота (HNO3) может окислять органические соединения, такие как спирты или аминокислоты, превращая их в соответствующие карбоновые или нитро соединения.
- Реакция азотной кислоты с углеводородами может приводить к нитрации их бензольных ядер, образуя нитроароматические соединения.
-
Реакции с другими веществами:
- С ацетоном (CH3COCH3) азотная кислота может взаимодействовать и формировать кетонитрат (CH3C(NO2)2CH3) и воду.
- Реакция азотной кислоты с аммиаком (NH3) приводит к образованию аммония нитрата (NH4NO3).
Учтите, что даны не все возможные реакции, но указанные выше являются основными и характерными реакциями азотной кислоты с различными классами веществ.
Применение азотной кислоты (HNO3) в промышленности и лабораторных условиях
Применение азотной кислоты в промышленности:
- Производство удобрений: Азотная кислота является одним из основных компонентов, используемых для производства азотных удобрений, таких как аммиак и аммиачная селитра.
- Производство взрывчатых веществ: Азотная кислота используется в процессе производства взрывчатых веществ, таких как тротил и нитроглицерин.
- Производство синтетических волокон: Азотная кислота применяется при производстве синтетических волокон, таких как нейлон и полиэстер.
- Гальванизация: В процессах гальванизации и электролиза азотная кислота используется для очистки и обработки поверхности металлических изделий.
- Производство жидкости для охлаждения двигателей: Азотная кислота является основным компонентом жидкости, используемой для охлаждения двигателей в авиации и ракетостроении.
Роль азотной кислоты (HNO3) в лабораторных условиях и научных исследованиях:
- Реагент и каталитическое вещество: Азотная кислота широко используется как реагент во множестве химических реакций и как каталитическое вещество для ускорения реакций.
- Определение концентрации протонов: В химическом анализе азотная кислота играет важную роль в определении концентрации протонов в различных реакциях и смесях.
- Синтез органических соединений: Азотная кислота может служить исходным материалом для синтеза многих органических соединений, таких как амины и нитроароматические соединения.
- Анализ почвы и растений: Азотная кислота используется для экстракции и определения содержания нитратов и других азотных соединений в почве и растениях.
- Исследование окислительности: Азотная кислота может быть использована для измерения окислительных свойств различных веществ и материалов.
Влияние азотной кислоты на окружающую среду и здоровье
Азотная кислота (HNO3) является важным химическим соединением, которое широко используется в промышленности и сельском хозяйстве. Однако, излишнее присутствие азотной кислоты в окружающей среде может иметь негативное влияние на экосистемы и здоровье людей и животных.
Следующие являются основными негативными воздействиями азотной кислоты на окружающую среду:
- Кислотные осадки: Высокие концентрации азотной кислоты в атмосфере приводят к образованию кислотных осадков при сочетании с другими загрязнителями воздуха, такими как оксиды серы и аммиак. Кислотные осадки портят почву, загрязняют поверхностные водоемы и влияют на водные экосистемы. Это может привести к исчезновению рыб и других водных организмов, негативно влиять на растительность и водопроницаемость почвы.
- Увеличение эффекта парникового газа: Высокие уровни азотной кислоты способствуют формированию озона в нижней атмосфере, что напрямую связано с увеличением парникового эффекта и изменением климата.
- Загрязнение водных ресурсов: Использование азотной кислоты в сельском хозяйстве может привести к загрязнению поверхностных и подземных вод. Выщелачивание нитратов из почвы и их просачивание в водные ресурсы может вызвать проблемы с здоровьем, такие как нитратоемкое количественное увеличение заболеваний у животных и людей, включая метгемоглобинемию у детей.
Влияние азотной кислоты на здоровье людей и животных включает:
- Заболевания дыхательной системы: Высокие концентрации азотных оксидов в атмосфере, образующихся при сжигании ископаемого топлива и промышленной деятельности, могут вызвать проблемы с дыханием, такие как астма и бронхит.
- Токсичность для животных: Постоянное воздействие азотной кислоты на животных может вызывать печеночный некроз, гастроэнтерит и другие заболевания.
- Риск развития рака: Высокие уровни нитратов в пищевых продуктах, вызванные загрязнением водных ресурсов азотной кислотой, могут повышать риск развития рака, особенно рака желудка.
Интенсивный контроль выбросов азотных оксидов и правильное управление использованием азотной кислоты могут помочь снизить негативное влияние на окружающую среду и здоровье. Это может включать использование более эффективных удобрений и технологий, а также сокращение выбросов воздушных загрязнений на промышленных предприятиях.
Меры безопасности при работе с азотной кислотой
Меры безопасности при работе с азотной кислотой очень важны, так как это химическое вещество является сильным окислителем и может быть опасным при несоблюдении соответствующих мер предосторожности. Несоблюдение правил безопасности может привести к серьезным последствиям, включая ожоги, взрывы или отравление.
Вот некоторые рекомендации и правила безопасной работы с азотной кислотой:
- Личная защита: при работе с азотной кислотой необходимо использовать защитные очки, резиновые перчатки, защитную одежду и респиратор. Это поможет предотвратить контакт с кислотой и ее паров, которые могут вызвать ожоги и другие повреждения.
- Хранение и транспортировка: азотная кислота должна храниться в специально предназначенных контейнерах, обязательно дистанцируемых от воспламеняющихся веществ. Контейнеры с кислотой должны быть герметично закрытыми и храниться в прохладном, хорошо проветриваемом помещении.
- Работа в хорошо проветриваемом помещении: при работе с азотной кислотой необходимо обеспечить достаточную вентиляцию, чтобы избежать скопления паров кислоты, которые могут быть опасными для дыхательной системы.
- Избегать контакта с другими веществами: азотная кислота может реагировать с другими химическими веществами и вызывать опасные реакции. Поэтому необходимо избегать контакта с органическими веществами, аммиаком, ацетоном или другими горючими и хлорсодержащими веществами.
- Безопасное разливание и перемещение: при разливании азотной кислоты следует использовать специальные наливные устройства, чтобы избежать разбрызгивания и возможных ожогов. Перемещение контейнеров с кислотой должно выполняться осторожно и без риска их повреждения.
- Первая помощь и экстренные меры: в случае контакта с азотной кислотой необходимо сразу промыть затронутые участки кожи или глаз большим количеством воды. При необходимости обратитесь за медицинской помощью. Для экстренных случаев должна быть доступна душевая и другое оборудование для промывания.
Соблюдение этих мер безопасности при работе с азотной кислотой снизит риск возникновения аварийных ситуаций и позволит обеспечить безопасное рабочее окружение.
Сравнение азотной кислоты с другими кислотами
Азотная кислота (HNO3) является одной из наиболее распространенных и важных кислот, используемых в химической промышленности и лабораторных условиях. Ее свойства и характеристики обладают рядом отличительных особенностей по сравнению с другими кислотами.
Производство и стабильность:
- Азотная кислота производится путем окисления аммиака (NH3), что отличает ее от других кислот, которые могут иметь различные происхождения.
- HNO3 является относительно стабильной кислотой, несколько более стабильной чем серная кислота (H2SO4) или фосфорная кислота (H3PO4), что делает ее более безопасной для хранения и транспортировки.
Кислотные свойства:
- Азотная кислота является сильной кислотой с высоким содержанием водорода и ионов H+. Она более кислая по сравнению с уксусной кислотой (CH3COOH) или лимонной кислотой (C6H8O7), что делает ее более реактивной и агрессивной.
- Кроме того, азотная кислота является окислителем и может быть использована для окисления других веществ, в то время как большинство других кислот обычно используются в качестве растворителей или реагентов.
Химические реакции:
- Азотная кислота (HNO3) обладает способностью проявлять амфотерные свойства, то есть она может вести себя как кислота и основание одновременно. Это отличает ее от большинства других кислот, которые обычно могут проявлять только кислотные свойства.
- Кроме того, азотная кислота обладает способностью диссоциировать на ионы H+ и NO3-, обусловливая ее способность реагировать с различными веществами и создавать разнообразие продуктов.
Области применения:
- Азотная кислота широко используется в производстве удобрений, взрывчатых веществ, пластмасс, красителей, фармацевтических препаратов и других химических продуктов.
- В медицинских и лабораторных условиях азотная кислота применяется для проведения различных анализов, задач окрашивания тканей, смачивания и стерилизации инструментов.
В итоге, азотная кислота отличается от других кислот в своем производстве, стабильности, кислотных свойств, реакций и областей применения. Ее высокая реактивность и широкий спектр применений делают ее важным компонентом в химической и промышленной сфере.
История открытия и развития изучения азотной кислоты (HNO3)
Изучение азотной кислоты имеет долгую и интересную историю, начиная со времен ее первого открытия. В этой статье мы рассмотрим исторический обзор открытия и изучения азотной кислоты, а также вклад знаменитых ученых в ее развитие.
Открытие азотной кислоты уходит корнями во вторую половину XVIII века. В 1776 году шведский химик Карл Шееле изолировал из земли вещество, которое он назвал азотной кислотой. Он смог получить ее путем окисления азота воздуха при помощи концентрированной серной кислоты. Несколько лет спустя, в 1785 году, французский химик Клод Бертолле получил азотную кислоту путем действия соляной кислоты на серу, которая в свою очередь получалась из аммиака.
Однако именно шведский ученый Йонас Берзелиус сделал большой вклад в изучение азотной кислоты. В 1818 году он разработал метод синтеза азотной кислоты путем действия соляной кислоты на серу при наличии соли железа. Этот метод получения азотной кислоты нашел широкое применение в промышленности и позволил производить ее массово.
Затем, в 1838 году, немецкий химик Хенрих Бёшер обнаружил способ синтеза азотной кислоты с использованием соляной кислоты, азота и катализатора. Этот метод стал новым прорывом в производстве азотной кислоты и использовался на протяжении многих десятилетий.
Важный вклад в развитие изучения азотной кислоты внесли также ученые Анри Леклерк и Анри Сент-Клерк Дюпюи. В 1841 году они разработали метод получения азотной кислоты с использованием сосудов с двумя секциями. Один сосуд содержал аммиак, а другой – соляную кислоту. При помощи клинчатых сосудов они обеспечивали их смешивание и реакцию, результатом которой становилась азотная кислота.
Следующий знаменитый ученый, который сделал важный вклад в изучение азотной кислоты, был Александер Ривунер. В 1875 году он разработал метод получения азотного триоксида, или азотного газа, путем окисления аммиака. Этот газ затем реагировал с водой, образуя азотную кислоту. Такой метод синтеза стал основой для промышленного производства азотной кислоты.
Современное изучение азотной кислоты (HNO3) включает в себя как фундаментальные исследования ее свойств и реакций, так и применение в различных отраслях промышленности и медицине. Азотная кислота является важным химическим соединением, которое находит широкое применение в производстве удобрений, взрывчатых веществ, а также в качестве очистителя и дезинфицирующего средства.
В заключение, множество ученых сделало огромный вклад в открытие и изучение азотной кислоты. Их работа позволила развить различные методы синтеза этого важного соединения, которое оказало огромное влияние на промышленность и науку. Изучение азотной кислоты продолжается до сих пор, и это соединение продолжает быть объектом активных исследований в различных областях химии и биологии.
Заключение
В данной статье были рассмотрены различные аспекты азотной кислоты - ее определение, свойства, процесс получения, реакции, применение, влияние на окружающую среду и здоровье, меры безопасности. Также были проведены сравнения с другими кислотами и рассмотрена история открытия и развития изучения азотной кислоты.
Исследования в области азотной кислоты (HNO3) имеют большую значимость и перспективы. Эта кислота широко используется в промышленности и научных исследованиях, а также играет важную роль в различных отраслях. Однако необходимо учитывать ее негативное воздействие на окружающую среду и здоровье людей и животных.
При работе с азотной кислотой необходимо строго соблюдать меры безопасности и следовать рекомендациям и правилам работы с ней. Сравнение азотной кислоты с другими кислотами позволяет выявить ее особенности и области применения.
История открытия и развития азотной кислоты свидетельствует о значимости этого вещества в научных исследованиях и его важности для различных отраслей.
Обобщая, исследования в области азотной кислоты имеют широкие перспективы и значимость, однако необходимо учитывать ее воздействие на окружающую среду и здоровье. Безопасность при работе с азотной кислотой является приоритетом, а история ее изучения подчеркивает важность этого вещества в научных исследованиях и промышленности.
